近日,附属第二医院何松、周智航领衔的消化道早癌研究团队在国际高水平期刊iMeta上发表了题为Single-cell sequencing reveals the role of IL-33+ endothelial subsets in promoting early gastric cancer progression的研究论文。该研究通过构建高质量的单细胞RNA测序(Single-cell sequencing,scRNA-seq)图谱,揭示了早期胃癌(Early gastric cancer,EGC)肿瘤微环境中的关键细胞亚群及其分子机制,为胃癌的早期诊断和治疗提供了新的理论依据和潜在靶点。
研究揭示IL-33+内皮细胞亚群在胃早癌中的关键作用
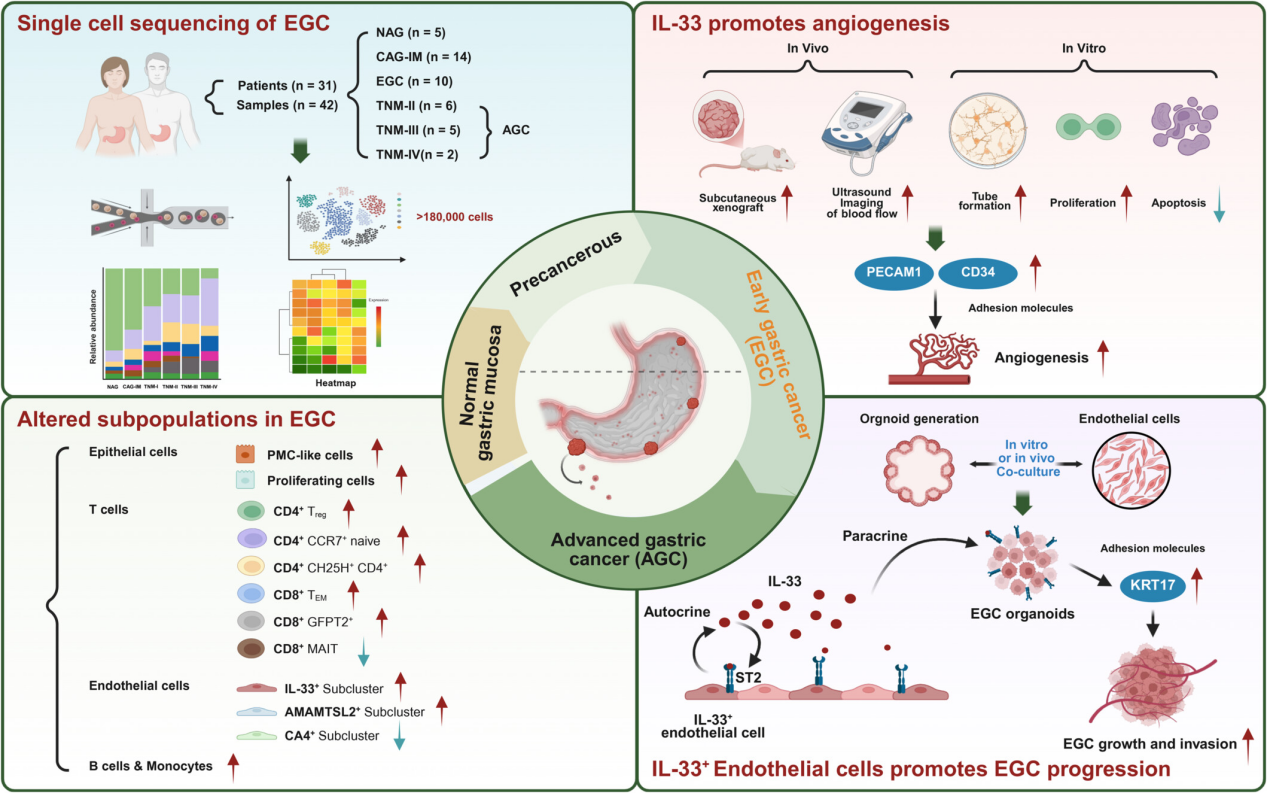
早期胃癌(EGC)是预防胃炎向晚期胃癌(Advanced gastric cancer,AGC)发展的关键阶段。然而,EGC的肿瘤微环境(Tumor microenvironment,TME)复杂,其细胞组成和分子机制尚未完全阐明。研究团队利用临床活检和手术样本,构建了包含184,426个细胞的scRNA-seq图谱,系统分析了EGC的细胞组成、基因表达、谱系分化及细胞间通讯等特征。研究发现,EGC中存在8种不同的细胞谱系状态,其中IL-33+内皮细胞亚群在EGC进展中发挥了关键作用。该亚群通过上调粘附蛋白CD34和PECAM1的表达,促进内皮细胞存活和血管生成,进而推动EGC向AGC发展。此外,该团队还构建了EGC类器官样本库,发现IL-33+内皮细胞亚群能够通过上调KRT17等分子促进EGC类器官生长。最后,IL-33的高表达与EGC的粘膜浸润深度和恶性程度呈正相关,提示其可作为EGC进展的潜在预测标志物和治疗靶点。
为深入解析早期胃癌(EGC)的分子机制,研究团队整合运用了多项前沿技术:通过高质量单细胞RNA测序(scRNA-seq),构建覆盖不同疾病分期的胃癌高分辨率单细胞图谱,系统解析肿瘤细胞与微环境细胞的互作网络;基于类器官-内皮细胞共培养模型开展体外实验,证实关键因子IL-33对内皮细胞功能的特异性调控;利用小鼠模型进行体内实验,明确IL-33+内皮细胞亚群对EGC进展的促进作用;结合超声微血管成像与转录组测序,进一步阐明IL-33介导肿瘤血管生成的分子机制。这种多技术平台的整合应用,为研究结论提供了多维度、相互印证的坚实数据支撑,为未来胃癌的精准诊疗策略奠定了重要科学基础。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/imt2.70050