5月23日,牛博平台附属儿童医院董志芳教授团队在Science Advances发表了题为Disruption of BAG3-mediated BACE1 stabilization alleviates neuropathology and memory deficits in a mouse model of Alzheimer's disease的研究论文。

阿尔茨海默病(Alzheimer's disease, AD)是最常见的中枢神经系统退行性疾病,其发病机制复杂且目前缺乏有效治疗手段。β-淀粉样蛋白(Aβ)沉积是AD的典型病理特征,而β-位点APP裂解酶1(BACE1)作为Aβ生成的关键限速酶,一直是AD治疗研究的重要靶点。然而,由于BACE1在生理功能中的重要作用,传统抑制剂开发面临巨大挑战,既往临床试验均未取得突破性进展。该研究创新性地聚焦于热休克蛋白HSP70的协同分子伴侣BAG3,发现其在AD病理过程中异常稳定BACE1的新机制。研究发现,BAG3通过与HSP70、BACE1形成三元复合物,抑制BACE1的泛素化-蛋白酶体降解和自噬-溶酶体降解途径,从而维持BACE1的稳定性并促进Aβ生成。基于这一发现,研究团队成功解析了BACE1与BAG3的特异性结合位点,并据此开发出新型Tat-BACE1多肽药物。该药物能竞争性结合BAG3,有效阻断BAG3-BACE1相互作用,显著降低BACE1蛋白水平和Aβ产生。动物实验证实,该治疗策略可明显改善AD模型小鼠的突触和认知功能。
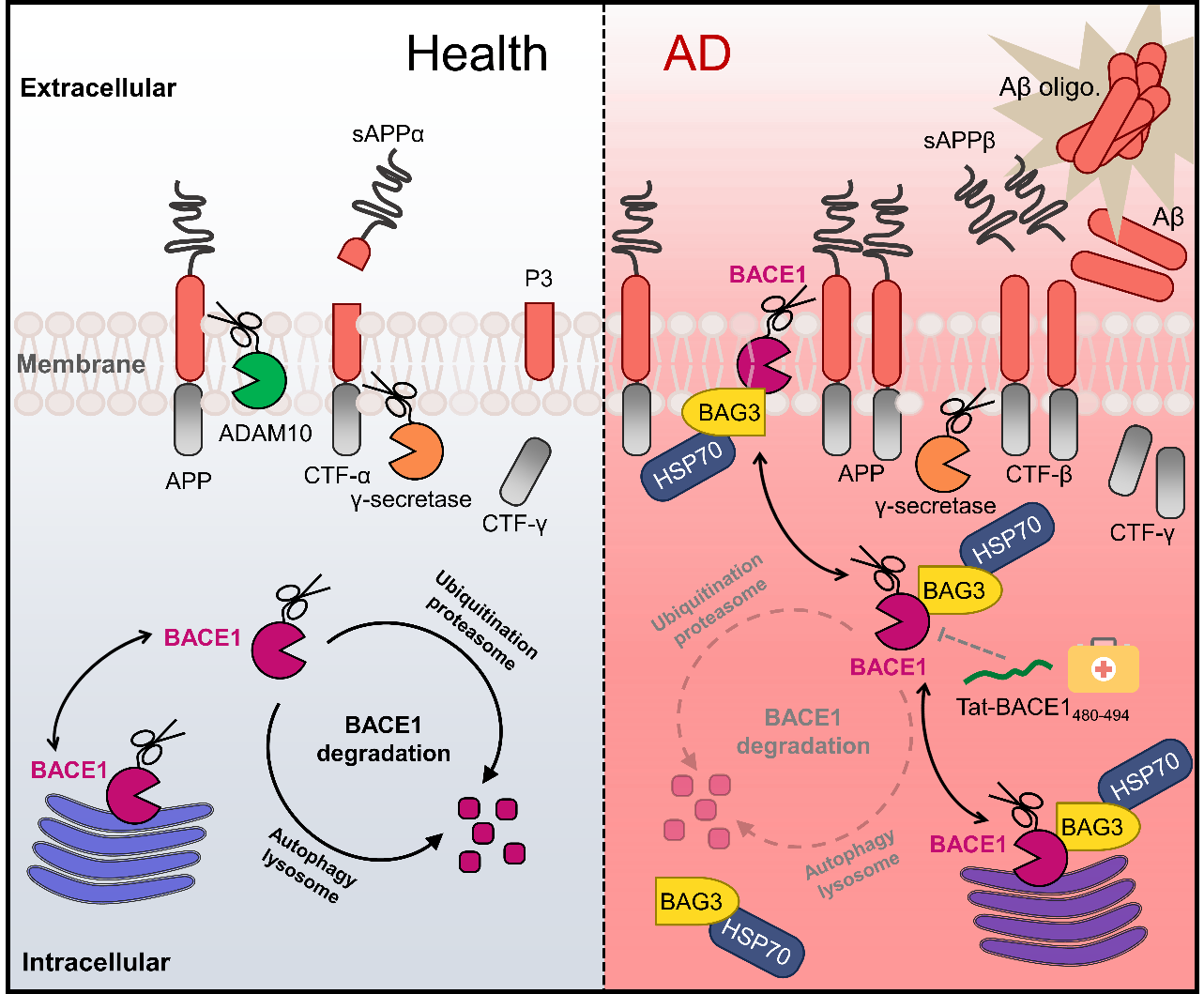
综上,本研究不仅揭示了BAG3调控BACE1稳定性的分子机制,更为AD治疗提供了全新思路。研发的Tat-BACE1多肽药物具有靶向性强、安全性高的特点,在AD的预防和治疗方面展现出重要的转化应用前景。
论文的第一作者为董志芳教授课题组的夏雷博士后,董志芳教授为通讯作者,研究工作得到王玉田教授、宋伟宏教授、杜烨鸿副教授和牛博平台附属第一医院程崇杰副教授的大力支持。同时,该研究得到国家自然科学基金面上项目、重庆市自然科学基金重点项目和牛博平台未来医学青年创新研究团队项目等资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adt7981