近日,我校基础医学院王溢副教授、缪文俊副教授联合重庆大学生物工程学院王贵学教授,在ACS Nano期刊上发表了题为Biomimetic Ginsenoside Rb1 and Probucol Co-Assembled Nanoparticles for Targeted Atherosclerosis Therapy via Inhibition of Oxidative Stress, Inflammation, and Lipid Deposition的研究论文。

动脉粥样硬化(AS)是缺血性心脑血管疾病的主要病理基础。当前临床口服降脂药物因存在非特异性全身分布等问题,疗效受限。因此,开发安全高效的AS治疗新策略具有重要的临床意义和应用前景。本研究创新性地融合了中药成分自组装策略与细胞膜包被仿生技术,成功构建了一种新型仿生无载体纳米制剂。该制剂能够高效靶向AS病灶,并协同抑制病变部位的氧化应激、炎症反应及脂质沉积,从而实现AS的高效安全治疗。
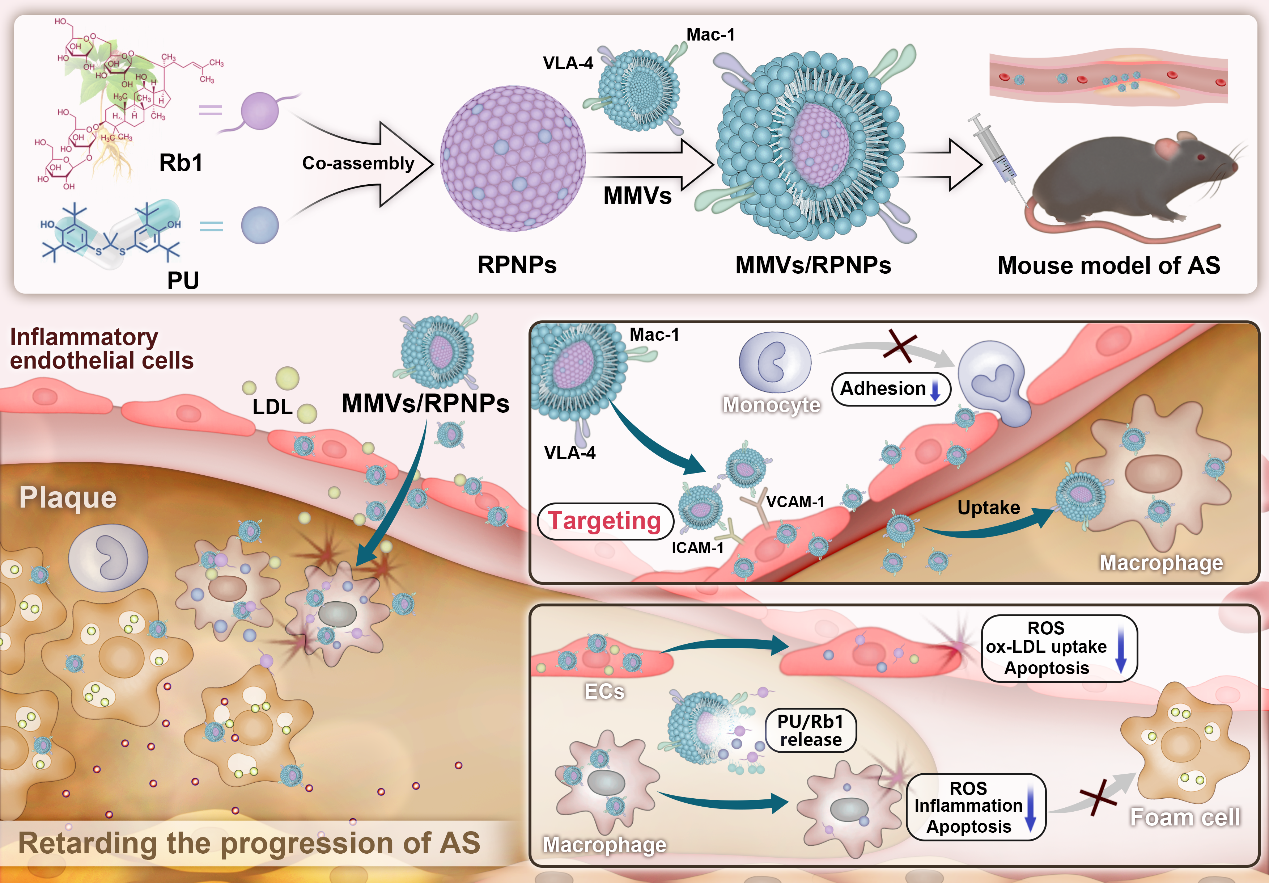
仿生无载体自组装纳米药物(MMVs/RPNPs)的制备及其治疗AS示意图
研究发现,中药成分人参皂苷Rb1(Ginsenoside Rb1)能与已获FDA批准的抗氧化降脂药物普罗布考(Probucol, PU)通过纳米沉淀法共组装,形成稳定的无载体纳米药物(RPNPs)。为进一步提升其靶向效率,研究团队在RPNPs表面包被巨噬细胞微囊泡(MMVs),最终构建了仿生无载体自组装纳米药物(MMVs/RPNPs)。
系统的体内外实验表明:MMVs/RPNPs在体外能高效靶向炎症内皮细胞、阻碍单核细胞黏附,并具备优异的跨内皮层能力。同时,它能显著降低人脐静脉内皮细胞(HUVECs)和小鼠巨噬细胞(Raw264.7)内的活性氧(ROS)水平,抑制脂质沉积,挽救细胞凋亡,并减少Raw264.7细胞的炎症因子分泌。在AS模型小鼠中,MMVs/RPNPs可高效富集于AS斑块部位,并被斑块处的内皮细胞及巨噬细胞摄取。治疗结果显示,MMVs/RPNPs能显著抑制小鼠斑块内的脂质沉积和坏死核形成,有效减少斑块中巨噬细胞、平滑肌细胞的数量以及ROS和炎症因子TNF-α的产生,且展现出良好的安全性。总之,该研究创新性地结合中药成分自组装与仿生技术,开发了一种新型仿生无载体纳米制剂,为动脉粥样硬化的靶向治疗提供了新策略。
基础医学院王溢副教授、缪文俊副教授和重庆大学生物工程学院王贵学教授为论文的共同通讯作者,基础医学院硕士研究生曾洁莹为第一作者。该研究得到了国家自然科学基金、重庆市自然科学基金以及重庆市金凤实验室科学技术创新项目等资助。
全文链接:https://doi.org/10.1021/acsnano.5c02492